EMA-FDA: efficacia e sicurezza dei farmaci equivalenti
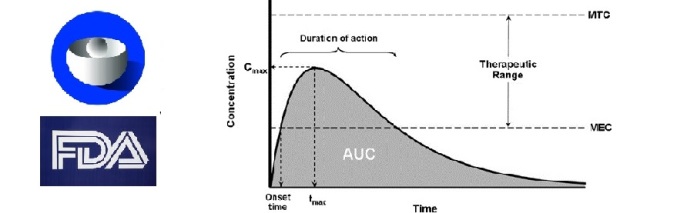
La European Medicines Agency (EMA) e la Food and Drug Administration (FDA) hanno annunciato l'avvio di una iniziativa congiunta per condividere le informazioni relative agli studi di bioequivalenza condotti nell'ambito delle richieste di autorizzazione all'immissione in commercio dei farmaci equivalenti.
Registrati per leggere il seguito...