Comunicato del MdS sull'endometriosi

L'endometriosi è una malattia che colpisce tante donne ed è una delle cause più frequenti di sterilità.

L'endometriosi è una malattia che colpisce tante donne ed è una delle cause più frequenti di sterilità.

L'Agenzia Europea dei Medicinali ( EMA) ha terminato di esaminare tutte le osservazioni pervenute sulla proposta di policy in materia di pubblicazione e accesso ai dati degli studi clinici.

L'influenza ha colpito 81 mila italiani nella prima settimana di dicembre, a riportarlo sono i dati dell'ultimo rapporto Influnet, elaborati dal Centro nazionale di epidemiologia, sorveglianza e promozione della salute dell'Istituto superiore di sanità.

Il Ministero ha chiesto il supporto alla FOFI, e conseguentemenate anche alla SIFO, per la diffusione della locandina presso i propri iscritti, al fine del raggiungimento di un comune obiettivo di salute pubblica.

L'Agenzia Europea dei Medicinali ( EMA) ha pubblicato un rapporto che evidenzia i risultati del workshop sulla terapia antibiotica e sul modo di contrastare il problema della resistenza.

Il 17 e il 18 dicembre 2013, presso l'Auditorium Antonianum di Roma, si terrà la VI Conferenza Nazionale sui Dispositivi Medici, organizzata dalla Direzione Generale Farmaci e Dispositivi Medici del Ministero della Salute.

L'Agenzia Italiana del Farmaco, in accordo con l'Agenzia Europea dei Medicinali, rende disponibili nuove e importanti informazioni su reazioni cutanee gravi associate a capecitabina.

Nel 2012 l'Agenzia Italiana del Farmaco, ha attivato un progetto ad hoc per la predisposizione e l'invio di informazioni di ritorno ai segnalatori di sospette reazioni avverse (ADR) gravi e inattese provenienti dalle 5 Regioni italiane in cui non sono stati ancora istituiti i Centri Regionali di Farmacovigilanza (CRFV).

Il Registro del medicinale lenalidomide (Revlimid) 648 gestito su piattaforma Cineca verrà chiuso a far data dal 31 dicembre 2013 per scadenza contrattuale e quindi riattivato sulla nuova piattaforma AIFA dei Registri di Monitoraggio.
L'Agenzia Italiana del Farmaco, in accordo con l'Agenzia Europea dei Medicinali, rende disponibili nuove e importanti informazioni su pazienti trattati con temozolomide nei quali sono stati riportati casi di danno epatico, inclusa l'insufficienza epatica fatale.

L'ultimo caso è avvenuto all'ospedale di Tolmezzo, il 5 dicembre. A novembre erano accaduto agli ospedali di Salerno, Cremona, Isernia e Treviglio. Il fenomeno del furto di farmaci dagli ospedali italiani sta crescendo.

Pubblicati sulla Gazzetta Ufficiale della Repubblica Italiana (4a Serie speciale - Concorsi).
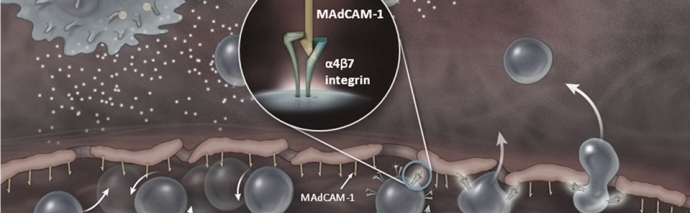
Un gruppo congiunto di esperti della Food and Drug Administration (FDA) si è pronunciato dando parere positivo per l'approvazione di vedolizumab per il trattamento di adulti con colite ulcerosa da moderata ad attiva grave e malattia di Crohn.
Dopo la comunicazione AIFA del 15 novembre 2013, in riferimento all'inserimento nella lista di trasparenza di specialità medicinali contenenti levotiroxina sodica, per quanto riguarda gli analoghi generici, le Società Scientifiche AIT (Associazione Italiana della Tiroide), AME (Associazione Medici Endocrinologi), SIE (Società Italiana di Endocrinologia) e SIEDP (Società Italiana di Endocrinologia e Diabetologia Pediatrica) hanno siglato un documento condiviso al riguardo, di cui riportiamo le parti più significative.
L'Agenzia Italiana del Farmaco intende fare chiarezza sulla somministrazione del vaccino antiinfluenzale ai bambini e alle donne in gravidanza.

A seguito di una segnalazione pervenuta all'Agenzia Italiana del Farmaco (AIFA), relativa al dosaggio del farmaco riportato sulle buste di ketoprofene sale di lisina Ratiopharm, è emerso che in alcuni lotti del medicinale "Ketoprofene sale di lisina Ratiopharm 80 mg granulato per soluzione orale - 30 bustine bipartite", il dosaggio "80 mg" è stato stampato su entrambe le mezze buste, costituenti l'unità del farmaco, mentre ciascuna busta contiene correttamente 40 mg.

L'Agenzia Italiana del Farmaco comunica che sono disponibili le nuove Determinazioni AIFA per singolo principio attivo e medicinale per la classe delle incretine e simili (aggiornamento del 9 dicembre 2013).

La US Food and Drug Administration (FDA) ha approvato sofosbuvir per il trattamento del virus dell'epatite C cronica ( HCV). Sofosbuvir è il secondo farmaco approvato dalla FDA nelle ultime due settimane per trattare l'infezione cronica da HCV.
Disponibile la nuova applicazione che consente ai farmacisti ospedalieri di valutare la qualità del servizio e tenere traccia degli obiettivi raggiunti nel processo di gestione del farmaco.

L'European Medicines Agency (EMA) ha avviato una approfondita revisione dei benefici e dei rischi del farmaco per la leucemia ponatinib e in particolare del rischio di coaguli di sangue, o ostruzioni arteriose, o venose associate al suo impiego.

L'Agenzia Italiana del Farmaco ha istituito la nota 94: la determina è stata pubblicata in Gazzetta Ufficiale (Serie Generale, n. 285 del 5.12.13). La nota riguarda la prescrivibilità SSN degli Omega-3.
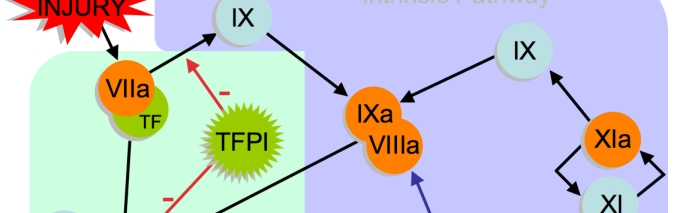
Il Comitato di valutazione dei rischi per la farmacovigilanza (PRAC) dell'Agenzia Europea dei Medicinali ha esaminato i medicinali Kogenate e Helixate e ha concluso che le evidenze attuali non hanno confermato un aumento del rischio di sviluppare anticorpi (inibitori del fattore VIII) verso questi medicinali rispetto ad altri prodotti a base di fattore VIII in pazienti precedentemente non trattati con la patologia emorragica emofilia A.

Nuovi dati clinici presentati dal titolare dell'Autorizzazione all'Immissione in Commercio e valutati a livello europeo, hanno evidenziato che l'effetto contraccettivo è ridotto nelle donne il cui peso è superiore o uguale a 75 kg e che levonorgestrel non è più efficace nelle donne il cui peso è superiore o uguale a 80 kg.

In occasione del XXXIV Congresso Nazionale SIFO, svoltosi a Torino dal 17 al 21 Ottobre 2013, sono stati premiati i migliori poster presentati dai colleghi farmacisti provenienti da tutta Italia.

Ricercatori della Università di Dundee e dello University College di Londra hanno scoperto come alcuni medicinali in formulazioni effervescenti di uso comune, come aspirina, vitamine, digestivi ed antiacidi siano associate a un aumento del 16% del rischio di incorrere in eventi cardiovascolari, come infarto e attacchi di cuore.

Il Centro Nazionale per l'Influenza dell'Istituto Superiore di Sanità ha comunicato il primo isolamento di virus influenzale della stagione 2013-2014. Appartiene al tipo A che, sulla base dei dati attualmente disponibili, si presume sia correlato a uno dei tre ceppi contenuti nel vaccino attualmente in uso.

L'Agenzia Italiana del Farmaco rende disponibili online aggiornamenti relativi al medicinale "Telzir (fosamprenavir) 50 mg/ml sospensione orale 1 flacone da 225 ml", non reperibile sul territorio nazionale per il quale è stata autorizzata l'importazione dall'estero su richiesta dell'azienda.

L'Agenzia Italiana del Farmaco (AIFA) informa i referenti e gli approvatori regionali dei Registri Farmaci sottoposti a Monitoraggio che a partire da giovedì 5 Dicembre p.v. saranno rilasciate ulteriori funzionalità proprie del profilo regionale e verrà introdotta la nuova modalità di accreditamento ed abilitazione all'utilizzo del sistema.
L'Agenzia Italiana del Farmaco, in accordo con l'Agenzia Europea dei Medicinali, rende disponibili nuove e importanti raccomandazioni relative all'utilizzo di prasugrel.
L'Agenzia Italiana del Farmaco, in accordo con l'Agenzia Europea dei Medicinali, rende disponibili nuove e importanti informazioni sull'ampliamento delle avvertenze circa il rischio di eventi vascolari occlusivi associato a ponatinib.