AIFA: registri farmaci sottoposti a monitoraggio

L'AIFA informa gli utenti dei Registri Farmaci sottoposti a Monitoraggio sugli aggiornamenti della piattaforma web dedicata.

L'AIFA informa gli utenti dei Registri Farmaci sottoposti a Monitoraggio sugli aggiornamenti della piattaforma web dedicata.
A partire dal 25 febbraio 2015 saranno apportate delle modifiche applicative alla Rete Nazionale di Farmacovigilanza (RNF). Ecco le principali novità per le strutture sanitarie pubbliche (ASL, IRCCS o AO).

La Food and Drug Administration (FDA) ha approvato lenvatinib per il trattamento di pazienti con carcinoma della tiroide differenziato progressivo refrattario al trattamento con terapia allo iodio radioattivo.
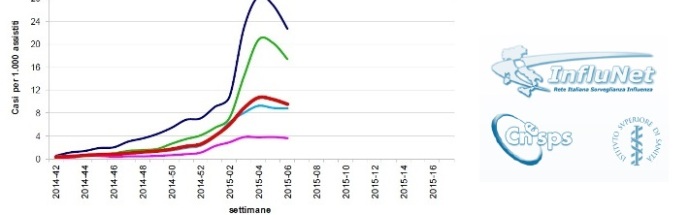
Il rapporto presenta i risultati nazionali e regionali relativi alla sorveglianza epidemiologica dell'influenza, elaborati dal Centro nazionale di epidemiologia, sorveglianza e promozione della salute dell'Istituto superiore di sanità.

Facendo seguito alle precedenti comunicazioni, l'AIFA informa gli utenti dei Registri di Monitoraggio sugli aggiornamenti della piattaforma web dedicata.

L'Agenzia Italiana del Farmaco rende disponibili aggiornamenti relativi a medicinali non reperibili sul territorio nazionale per i quali è stata autorizzata l'importazione dall'estero su richiesta delle rispettive aziende.

Si comunica che è stata revocata l'autorizzazione all'immisione in commercio o è stato disposto il ritiro di lotti dei medicinali di seguito indicati.
Nibtedanib è usato per il trattamento di adulti affetti da fibrosi polmonare idiopatica (IPF).

La prima edizione del testo Practical Pharmaceutics sarà presentata durante il Congresso EAHP, che si svolgerà ad Amburgo dal 25 al 27 marzo pv.
L'European Association of Hospital Pharmacists (EAHP), grazie ad una Direttiva comunitaria 2013/55/EU, ha istituito il "Common Training Framework" (CTF) con l'obiettivo di promuovere l'accrescimento della professionalità del Farmacista Ospedaliero in Europa e conseguentemente garantire un innalzamento dei livelli di salute Pubblica. Ultimo favorire la libera circolazione dei professionisti sanitari in Europa.

Si comunica che è stata revocata l'autorizzazione all'immisione in commercio o è stato disposto il ritiro di lotti dei medicinali di seguito indicati.

I comitati etici sono organismi indipendenti che hanno la responsabilità di garantire la tutela dei diritti, della sicurezza e del benessere delle persone in sperimentazione e di fornire pubblica garanzia di tale tutela.

Il farmaco è indicato per la cura di pazienti in post-menopausa con tumore metastatico positivo al recettore degli estrogeni (ER) e negativo al recettore del fattore di crescita epidermico HER-2, in prima linea in associazione con l'inibitore dell'aromatasi letrozolo, che non abbiano già ricevuto precedenti trattamenti per la malattia metastatica.

L'AIFA ha pubblicato l'aggiornamento della Lista dei Centri autorizzati dalle Regioni e dalle Province autonome alla prescrizione dei farmaci per il trattamento dell'infezione da virus dell'epatite C.

L'Agenzia Italiana del Farmaco rende disponibili aggiornamenti relativi a medicinali non reperibili sul territorio nazionale per i quali è stata autorizzata l'importazione dall'estero su richiesta delle rispettive aziende.

Concorso pubblico per la copertura di un posto di dirigente farmacista.

Facendo seguito alle precedenti comunicazioni, l'AIFA informa gli utenti dei Registri di Monitoraggio sugli aggiornamenti della piattaforma web dedicata.

Il Comitato per i Medicinali per Uso Umano (CHMP) dell'Agenzia Europea dei Medicinali (EMA) ha valutato i dati presentati dai titolari delle autorizzazioni alle immissioni in commercio dei medicinali contenenti ketoprofene per uso topico e ha riconfermato quanto già espresso nel 2010, ovvero che il profilo beneficio/rischio di questi farmaci rimane favorevole ma che esiste un rischio di reazioni di fotosensibilizzazione, in particolare un rischio di fotoallergia.

La Società Italiana di Nutrizione Artificiale e Metabolismo (SINPE) bandisce un concorso per il finanziamento di borse di studio e di progetti di ricerca clinica e/o di base sulla nutrizione artificiale e il metabolismo.

Si comunica che è stata revocata l'autorizzazione all'immisione in commercio o è stato disposto il ritiro di lotti dei medicinali di seguito indicati.

I farmaci approvati dall'Agenzia Europea dei Medicinali (EMA) nel mese di gennaio 2015.
L'Agenzia Italiana del Farmaco rende disponibili aggiornamenti relativi a medicinali non reperibili sul territorio nazionale per i quali è stata autorizzata l'importazione dall'estero su richiesta delle rispettive aziende.

Facendo seguito alle precedenti comunicazioni, l'AIFA informa gli utenti dei Registri di Monitoraggio sugli aggiornamenti della piattaforma web dedicata.

La Food and Drug Administration ha approvato un nuovo farmaco per controllare ipocalcemia in pazienti con ipoparatiroidismo, una malattia rara che colpisce circa 60.000 persone negli Stati Uniti.
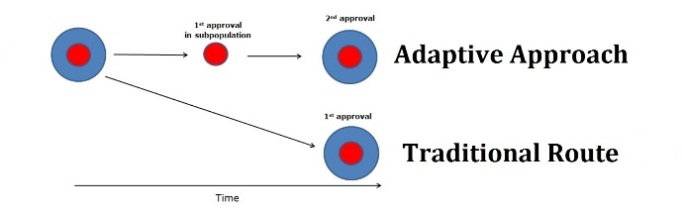
L'Agenzia Europea dei Medicinali (EMA) ha avviato il progetto pilota sui percorsi adattativi a marzo 2014. L'approccio dei percorsi adattativi ("adaptive licensing", noto anche come "approvazione sfalsata" o "licenza progressiva") rientra negli sforzi dell'Agenzia di migliorare tempestivamente l'accesso a nuovi farmaci da parte dei pazienti.

Il Ministero della Salute rende disponibili i dati relativi alla spesa rilevata dalle strutture sanitarie pubbliche del SSN per l'acquisto di dispositivi medici nel primo semestre 2014.

Il Comitato per i Medicinali per uso Umano (CHMP) dell'EMA ha adottato di nuovo un parere positivo raccomandando il rilascio dell'autorizzazione all'immissione in commercio per un nuovo farmaco destinato ai pazienti affetti da fibrosi cistica.

Si è tenuta in data 26 gennaio c.m, presso la sede del'Agenzia Italiana del Farmaco, la conferenza di presentazione del Rapporto sull'uso dei farmaci in Italia, relativa ai primi nove mesi dell'anno 2014, realizzato dall'Osservatorio sull'impiego dei medicinali dell'AIFA (OSMED).

L'Agenzia Italiana del Farmaco rende disponibili aggiornamenti relativi a medicinali non reperibili sul territorio nazionale per i quali è stata autorizzata l'importazione dall'estero su richiesta delle rispettive aziende.

Nei giorni 15 e 16 gennaio si sono svolte le fasi finali del premio qualità Joint Commission International 2015.