Tumore alla mammella: AIFA autorizza PHESGO e modifica Registro Perjeta
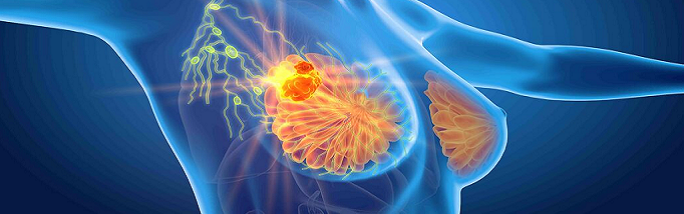
Si avvisa che dal 10.09.2022 è possibile utilizzare il medicinale PHESGO con chemioterapia nel trattamento adiuvante di pazienti adulti con carcinoma mammario HER2 positivo e che il registro di Perjeta ha sibito aggiornamenti.