CAR-T: Modifiche Registri KYMRIAH (DLCBL e LLA)

Si informano gli utenti dei Registri dei farmaci sottoposti a Monitoraggio che, a seguito dell’approvazione da parte della CTS, sono stati apportati degli aggiornamenti ai Registri Kymriah.

Si informano gli utenti dei Registri dei farmaci sottoposti a Monitoraggio che, a seguito dell’approvazione da parte della CTS, sono stati apportati degli aggiornamenti ai Registri Kymriah.

Si comunica che e' stata revocata l'autorizzazione all'immissione in commercio o disposto il ritiro di lotti dei medicinali di seguito indicati.
Il Comitato per i medicinali umani (CHMP) dell'EMA ha avviato una revisione dei dati per estendere l'uso di Imvanex, vaccino antivaiolo, anche per l’immunizzazione contro il vaiolo delle scimmie.
Il Centro Europeo per la Prevenzione ed il Controllo delle Malattie (ECDC) ha pubblicato la relazione tecnica “Countering online vaccine misinformation in the EU/EEA”e ha lanciato un corso on-line per imparare a contrastare la disinformazione sui vaccini.

La Commissione Europea ha approvato axicabtagene ciloleucel (Yescarta) il trattamento di pazienti adulti affetti da linfoma follicolare recidivante o refrattario ai trattamenti standard.

Dal 1° luglio 2022, l’accesso al Fondo nazionale AIFA 5% è gestito attraverso un servizio online dedicato, denominato “Gestionale Fondo 5%”.

L'AIFA aggiorna l'elenco dei medicinali che, a giudizio della Commissione Tecnico Scientifica, possiedono il requisito di innovatività terapeutica piena o condizionata.

Dal 01.07.2022 è possibile utilizzare, in regime di rimborsabilità SSN, il medicinale DAURISMO per il trattamento della leucemia mieloide acuta (LMA).

A partire dal 30.06.2022 è possibile utilizzare, in regime di rimborsabilità SSN, il medicinale BENLYSTA per il trattamento di pazienti adulti con nefrite lupica attiva.

Sono stati apportati degli aggiornamenti al Registro EVRYSDI per il trattamento dell'atrofia muscolare spinale (SMA).

E' stata pubblicata la nuova lista di trasparenza dei medicinali inseriti nell'elenco dei farmaci equivalenti (Legge 178/2002) con i relativi prezzi di riferimento aggiornati al 15 giugno 2022.

Si comunica che e' stata revocata l'autorizzazione all'immissione in commercio o disposto il ritiro di lotti dei medicinali di seguito indicati.

Si richiama l’attenzione degli operatori sanitari sul farmaco PLASMAGRADE® (plasma umano congelato).
L'EMA ha avviato revisione ciclica per l’aggiornamento della composizione del vaccino anti-COVID-19 Spikevax.
Il Comitato per i medicinali per uso umano (CHMP) dell’EMA ha raccomandato l’estensione dell’indicazione terapeutica per Nuvaxovid, in modo da autorizzarne la somministrazione negli adolescenti di età compresa tra 12 e 17 anni.

EMA ha raccomandato il rilascio dell’autorizzazione all’immissione in commercio per COVID-19 Vaccine Valneva inattivato, adiuvato, per la vaccinazione delle persone di età compresa tra 18 e 50 anni.

Il 20 giugno 2022 è entrata in funzione la nuova Rete Nazionale di Farmacovigilanza (RNF), il sistema con cui in Italia sono raccolte, gestite e analizzate le segnalazioni di sospette reazioni avverse a farmaci (ADR).

Si comunica che e' stata revocata l'autorizzazione all'immissione in commercio o disposto il ritiro di lotti dei medicinali di seguito indicati.
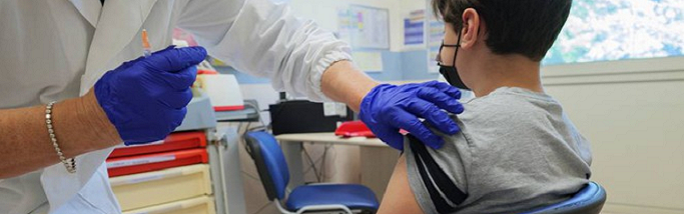
La statunitense Food and Drug Administration (FDA) ha comunicato di aver esteso l’autorizzazione all’uso di emergenza (EUA) dei vaccini per il COVID-19 di Pfizer-BioNTech e di Moderna anche per i bambini da 6 mesi in su.

Sono state inserite su DruGhost, il primo portale dei farmaci indisponibili, nuove segnalazioni relative all'indisponibilità farmaci.

L’Agenzia Europea del Farmaco (EMA) ha pubblicato la Relazione annuale 2021 che fornisce una panoramica delle attività svolte al fine di proteggere e promuovere nella Unione Europea la salute pubblica e la salute animale ed evidenzia i risultati più significativi conseguiti.

Si richiama l’attenzione sul farmaco Dexmedetomidina.

L'EMA ha avviato revisione ciclica per l’aggiornamento della composizione del vaccino anti-COVID-19 Comirnaty.

E' stata pubblicata la nuova lista di trasparenza dei medicinali inseriti nell'elenco dei farmaci equivalenti (Legge 178/2002) con i relativi prezzi di riferimento aggiornati al 15 giugno 2022.

Compie 70 anni la Societa' Scientifica dei Farmacisti Ospedalieri. Cavaliere: la professione ha percorso un cammino immenso. Oggi e' presenza autorevole e riconosciuta nella governance del farmaco.

Il comitato per la sicurezza dell'EMA (PRAC) ha raccomandato il ritiro delle autorizzazioni all'immissione in commercio dell'UE per i medicinali per l'obesità a base di amfepramone.

Si richiama l’attenzione sul farmaco Defitelio (defibrotide).